Atom yapısı ve Periyodik tablo
ÜZÜMLÜ KEK MODELİ (Thomson Atom Modeli)
Kek pozitif yüklere, üzümler ise negatif yüklere benzetilmiştir.
Thomson Atom Modeline göre;
- Atomun yapısında pozitif ve negatif yüklü tanecikler vardır. (+) ve (-) yükler eşittir. Bu nedenle atom yüksüzdür.
- Bu yükler homojen olarak dağılmıştır.
- Atom yarıçapı 10-8 cm olan pozitif yüklü küredir.
- Atom kütlesini büyük ölçüde pozitif yüklü tanecikler oluşturur.
MODELİN EKSİKLİĞİ
- Proton ve nötrondan bahsetmemiştir.
- (+) ve (-) yüklerin homojen olarak dağıldığı iddiası yanlıştır.
ÇEKİRDEKLİ ATOM MODELİ (Rutherford Atom Modeli)
- Bir altın tabakaya α taneciklerini göndererek ışınların levhaya çarptıktan sonra izledik yolları açıklamıştır. Bu ışınların çok büyük bir kısmının sapmadan geçtiğini, çok az bölünün saptığını ya da geri döndüğünü gözlemlemiştir.
- Bir atomun kütlesinin büyük bir kısmı ve pozitif yükün tamamı ÇEKİRDEK adı verilen çok küçük bölgede toplanmıştır.
- Atomlarda büyük boşluklar olduğu için α taneciklerinin büyük bir kısmı sapmadan geçmiştir.
- Pozitif yükleri dengeleyecek sayıda elektron bulunur.
- Pozitif yükler atom kütlesinin yaklaşık yarısına eşittir.
- Elektronlar çekirdeğin çevresinde gezegenlerin güneş çevresinde dolandığı gibi dönmektedir.
Modelin Eksikliği: Elektronun neden çekirdeğe düşmediği ya da atomdan fırlayıp gitmediği sorusunun cevapsız kalmasıdır.
YÖRÜNGELİ ATOM MODELİ (Bohr Atom Modeli)
Bohr’a göre;
- Bir atomdaki elektronlar çekirdekten belirli bir uzaklıkta dairesel yörüngelerde hareket eder.
- Elektronların dairesel hareket yaptığı yörüngelere KATMAN denir.
- Her bir yörüngenin enerjisi vardır.
- Temel enerji düzeyleri n=1, 2, 3, 4 gibi tamsayılarla ya da K; L; M; N; O gibi harflerle ifade edilir.
- Elektronlar çekirdekten dışarı doğru gidildikçe yörüngenin enerjisi artar. n=1 düşük enerji düzeyi yani temel haldir.
Yüksek enerjili seviyesinden düşük enerji seviyesine atlayan elektron foton salarak enerji yayar.
- Kararlı atomdaki elektronlar en düşük enerjili durumdadır.(Temel Hal)
- Atoma dışardan enerji verildiğinde yüksek enerji düzeylerine geçerek kararsız hale gelir. (Uyarılmış) Uyarılmış haldeki elektronlar temel hale geçerken Enerji kaybederler. Bu enerji dışarıya ışık enerjisi halinde verilir.
NOT: Atomların ışığı soğurmaları → Absorbsiyon
Atomların ışığı yaymaları → EMİSYON
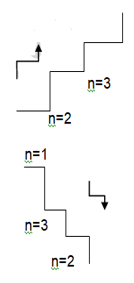
n = 1 den n = 2 ye çıkabilmesi için enerji absorplaması gerekir.
n = 2 den n = 1 e dönerken aradaki enerji farkı kadar ışın yayar.
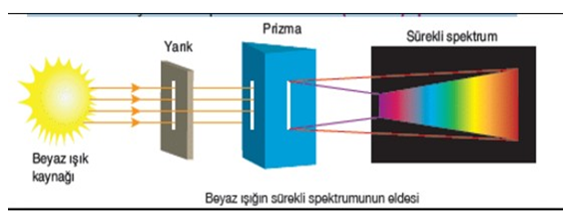
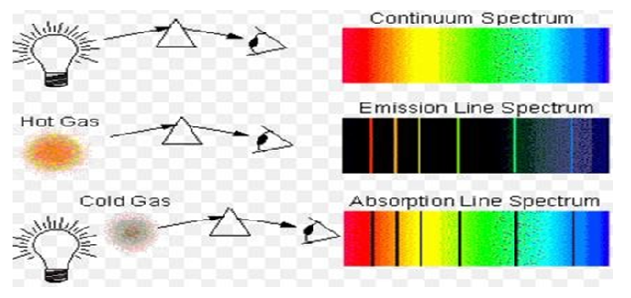
- Her atomun spektrumu kendine özgüdür.
- Farklı elementlerin atomları enerji alıp uyarıldıktan sonra temel hale dönerken o elemente özgü renklerde ışıklar yayar.
Havai fişeklerde her rengin oluşmasına farklı bir element yol açar.
BOHR ATOM MODELİNİN EKSİKLİKLERİ:
- Hidrojen gibi tek elektronlu atomların spektrumlarını açıklarken çok elektronlu atomlarınınkini açıklayamamıştır.
- Yörünge yerine elektronun bulunabilme olasılığının olduğu bölgelerden söz edilebilir.
Heisenberg ve Schrödinger modern atom teorisini temellerini atan çalışmalar yapmıştır.
ATOM ALTI TANECİKLER

Yukarıda C atomu sembolünün etrafındaki ifadeler şu anlama gelmektedir:
- A : Atomunun kütle numarasıdır.
- Her zaman sembolün sol üst köşesindeki değerdir.
- n.s. : Atomun nötron sayısıdır.
- Her zaman sembolün sol ortasındaki değerdir.
- p.s. : Atomun proton sayısıdır.
- Z harfi ile de gösterebilirdik. (Her zaman sembolün sol alt köşesindeki değerdir.)
- e.s. : Atomun elektron sayısıdır.
- Her zaman sembolün sağ alt köşesindeki değerdir.
- Yük: Atomun yüküdür.
- Her zaman sembolün sağ üst köşesindeki değerdir.
Atom numarası = proton sayısı = çekirdek yükü
Kütle numarası (Nükleon sayısı)=proton sayısı +nötron sayısı
Atomun Temel Tanecikleri İle İlgili Formüller

Atomların temel tanecikleri ile ilgili formüller şunlardır:
A = p.s. + n.s.
Yük = p.s. – e.s.
Bir atom iyon duruma geçtiğinde;
Proton sayısı
Çekirdek yapısı DEĞİŞMEZ
Nükleon sayısı
Çekirdeğin çekim gücü
Elektron sayısı
Fiziksel ve kimyasal özellikleri DEĞİŞMEZ
Çap hacmi
Elektron başına uygulanan çekim gücü
NOT: İki atomun
PROTON SAYISI = ELEKTRON SAYISI → KİMYASAL ÖZELLİKLERİ AYNIDIR
PROTON SAYISI =ELEKTRON SAYISI = NÖTRON SAYISI → FİZİKSEL ÖZELLİKLERİ AYNIDIR
İZOTOP ATOM
Proton sayıları aynı
Nötron sayıları farklı
Örnek: 35Cl 37Cl
- Kimyasal Özellikleri aynı
- Fiziksel özellikleri farklı
- Tabiatta bulunma yüzdeleri farklı
İki atomun kimyasal özelliklerinin aynı olması için:
- ikisinin de aynı sayıda protonu olmalı ve
- ikisinin de aynı sayıda elektronu olmalıdır.
İki atomun fiziksel özelliklerinin aynı olması için:
- atomların ikiz atomlar olması gerekir.
- Yani her şeyleri ile aynı olamayan atomların fiziksel özellikleri farklıdır.
İzotop atomlar, aynı elementin atomları oldukları için kimyasal özellikleri aynıdır, fakat fiziksel özellikleri farklıdır.
İZOTON ATOM
- Proton sayıları farklı
- Nötron sayıları aynı
- İzoton atomlar farklı elementlere ait atomlardır.
- İzoton atomların fiziksel ve kimyasal özellikleri farklıdır.
Örnek: 39K 37Cl
İZOBAR ATOM
- Proton sayıları farklı
- Kütle NO(Nükleon sayısı) aynı
- İzobar atomlar farklı elementlere ait atomlardır.
- Fiziksel ve kimyasal özellikleri farklıdır.
Örnek: 36Cl 36Ar
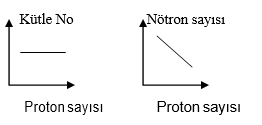
İZOELEKTRONİK ATOM
- Proton sayıları farklı olan taneciklerdir.
- Fiziksel ve kimyasal özellikleri farklıdır
- Elektron sayıları aynı
- Elektron dizilişleri aynı
Örnek: 11Na+1 13Ar+
ALLOTROP
- Bir elementin aynı tür atomlarının farklı kristal dizilişine sahiptir.
- Elmas → Grafit → Fulleren
- Oksijen Gazı → Ozon Gazı
- Rombik Kükürt → Monoklinik Kükürt Kırmızı
- Fosfor → Beyaz Fosfor → Siyah Fosfor
- Mermer → Kireç Taşı
Allotrop Elementlerde;
- Aynı tür atomlar içerirler
- Aynı elementle aynı tür bileşik oluştururlar
C(elmas) + O2(g) → CO2(g)
- Atomlar arası bağlar farklı
- Atomların dizilişi farklı
- Reaksiyona girme eğilimleri farklı
- Bağ enerjileri farklı
- Yoğunlukları farklı
PERİYODİK SİSTEM
Antoine-Laurent de Lavoisier 1789 yılında, dünyanın ilk modern kimya kitabı olarak kabul edilen
“Kimyanın Bilimsel İncelemesi” adlı kitabı yazdı.
Bu kitapta elementler; metal, ametal ve gaz olarak gruplanmıştı. Bugün bu gruplamayı yanlış olarak
bilsek de o günler için yeni keşiflerin önünü açması dolayısıyla çok önemli bir gelişmeydi.
TRİADLAR KURALI: İlk sınıflandırma
1.DÖBEREİNER
Elementleri üçerli gruplar halinde sınıflandırmıştır.
Döbereiner üçlü element gruplarında ortada bulunan elementin atom kütlesi, yoğunluk, en, kn, gibi bazı özelliklerinin diğer iki elementin ortalamasına yakın değerlere sahip olduğunu gösterir.
2.De Chancourtis
Elementleri ilk kez periyodik olarak tablolama girişiminde bulundu.
Chancourtois Benzer fiziksel özellik gösteren elementleri dikey sıralarda olacak şekilde sarmal olarak sıralamıştır
Tellür elementini merkeze yerleştirdiği ‘’ tellür spirali” tablosunda elementlerin kütle numaralarına göre grupladı.
16 parçalı bir silindire kütle numaralarına göre spiral şeklinde yerleştirilince dikey olarak sıralanan
elementlerin benzer olduğunu ve her 7 elementte bir tekrarladığını keşfetti.
Çok doğru tahminde bulunmasa da periyodik tablonun ilk resmedilmiş hali olduğu kabul edilir.
OKTAVLAR KURALI
Bilinen 63 elementi fiziksel özelliklerine göre 8 gruba ayırdı ve her sekizinci elementin birbiriyle
benzerlik gösterdiğini gördü; müzikal benzerliğinden ötürü bu yasaya “Oktavlar Kuralı” adını verdi.
Aslında Newlands “Oktavlar Kuralı”nı doğru çözümlemişti ama çalışmalarında aralık 8 değil 7 idi.
DİMİTRİ MENDELEYEV
Bugünkü kullandığımız periyodik sisteme en yakın elementler tablosunu DİMİTRİ MENDELYEV yapmıştır.
Mendelyev o dönemde bilinmeyen GALYUM; SKANDİYUM; GERMANYUM elementlerinin özelliklerini tahmin etmiştir.
Örneğin Silisyum elementinin altındaki yeri boş bırakmıştır. Buradaki bulunması gereken elemente Eka- Silisyum adını vermiş ve fiziksel ve kimyasal özellikleri hakkında tahminlerde bulunmuştur.
63 elementten oluşan periyodik çizelgesinde 12 yatay sıra ve 8 dikey sütun kullanmıştır.
Periyodik tablosu ile GRUP kavramını kazandırmıştır.
Elementleri artan atom ağırlıklarına göre yatay sıralamıştır.
Mendeleyev’in tek eksik noktası olarak ise soygazları öngörememesini gösterebiliriz.
NOT: Dimitri mendelyev ve Lothar Meyer aynı zamanda birbirlerinden habersiz birbirine çok benzer elementler tablosu oluşturarak periyodik sistemin ilk en düzenli örneğini oluşturmuştur. 1864 yılında Lothar Meyer, elementlerin değerlik elektron sayısını göz önüne alarak bir periyodik tablo hazırlanmıştır. Kütle numarasını yoksaydığından ve ileride keşfedilecek elementleri ön görmemiştir.
Ramsey soygazları keşfederek 8.sütun olarak sisteme eklemiştir.
Glenn Seaborg periyodik sistemin en altında yer alan iki sıra halindeki yapay elementlerin bir kısmını keşfederek periyodik sisteme son şeklini vermiştir.
HENRY MOSELEY
Moseley X ışınları deneyi ile elementlerin kimyasal özelliklerinin atomlarındaki proton sayısına (atom numarasına) bağlı olduğunu ortaya koydu.
- 1913 yılında Henry Moseley, Mendeleyev’in bir şekilde çözdüğü ama nedenini anlayamadığı tellür-iyot problemine ışık tuttu.
- Bu sistem büyük ölçüde doğru sonuç verse de bazen yanılabiliyordu.
- Moseley, X-ışını tabancasıyla bu iki elementin atom numaralarını belirledi ve bu sistemin
doğruluğu ispatlandı.
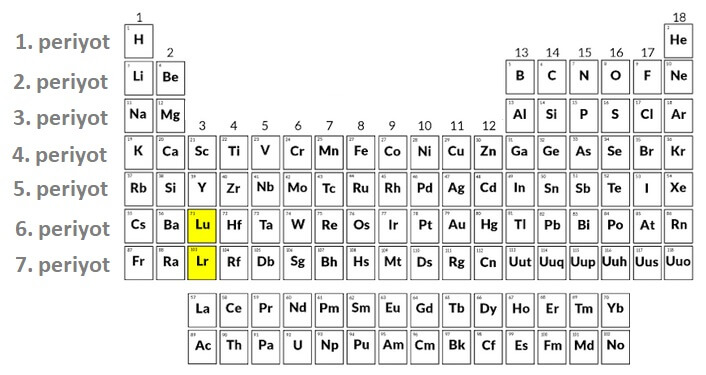
Günümüzdeki Periyodik Sistem
Günümüzün periyodik sisteminde, Mendeleyev’in tablosundaki gibi grup ve periyotlar vardır.
PERİYOT
Periyodik sistemde yatay sıralara PERİYOT denir.7 tane periyot vardır. Bir atomun en büyük enerji düzeyi periyodunu verir.
1 periyot: 2 element
2.ve 3. Periyotta 8 element
4.ve 5.periyotta 18 element
6. ve 7. periyotta 32 element
- Her periyot metalle başlayıp soygazla sona erer.(yalnız1.periyot Hidrojen ametalle başlar).
- İlk 3 periyotta B grubu elementi yoktur. B grubu elementleri 4.periyottan başlar.
GRUP
- Periyodik sistemde düşey sütunlara GRUP denir.Gruplar 1 den 18e kadar rakamla numaralandırılır.
- Aynı gruptaki elementlerin kimyasal özellikleri benzerdir.
- Değerlik Elektron Sayısı Grup No Verir
- A grubu elementlerine BAŞ GRUP elementleri; B grubu elementlerine YAN GRUP elementleri denir.


- 1A grubu: Alkali metaller (İstisna: Bu gruptaki H elementi, bir alkali metal değildir.)
- 2A grubu: Toprak alkali metaller
- 3A grubu: Toprak metalleri
- 4A grubu: Karbon grubu
- 5A grubu: Azot grubu
- 6A grubu: Oksijen grubu (Kalkojenler)
- 7A grubu: Halojenler (Tuz oluşturanlar)
- 8A grubu: Soy gazlar (Asal gazlar)
Grupların Özellikleri
Periyodik sistemdeki gruplar için şunlar söylenebilir:
- Periyodik sistemde, 18 tane grup vardır.
- Aynı grupta bulunun elementlerin kimyasal özellikleri benzerdir.
- Grup numarası, gruptaki element atomlarının son yörüngelerindeki elektron sayılarını verir:
- 1A grubundaki atomların son yörüngesinde 1 elektron vardır.
- 2A grubundaki atomların son yörüngesinde 2 elektron vardır.
- 3A grubundaki atomların son yörüngesinde 3 elektron vardır.
- ….
- 7A grubundaki atomların son yörüngelerinde 7 elektron vardır.
- 8A grubundaki atomların son yörüngelerinde 8 elektron vardır. İstisna: Helyum (He), bu kuralın istisnasıdır. He, 8A grubunda bulunur fakat değerlik elektron sayısı 8 değil 2’dir.
Son yörüngedeki elektron sayısı = Değerlik elektron sayısı
Periyotların Özellikleri
Periyodik sistemde 7 tane periyot vardır.
Periyot numaraları yukarıdan başlanarak verilmiştir.
Bir atomun, periyot numarası ile yörünge sayısı eşittir.
Örneğin;
- H (Hidrojen) atomu 1. periyottadır çünkü; H atomunda 1 tane yörüngesi vardır.
- Ca (Kalsiyum) atomu 4. periyottadır çünkü; Ca atomunun 4 tane yörüngesi vardır.
Periyodik Sistemde Lantanit ve Aktinitler
- Periyodik sistemin altında, ayrıca çizilen bir blok vardır. Bu bloktaki elementler Lantanit ve Aktinitlerdir.
Aşağıdaki periyodik sistemde, Lantanit ve Aktinitler gösteriliyor.

Lantanitler
- Lantanitler, Lantan (La) elementi ile başlayan periyottaki elementlerin ortak adıdır.
- Lantan elementi ile başladıkları için de “Lantanit” adını alırlar.
- Lantanitler, toplam 14 tanedir.
- Proton sayılarının takip edersek, Lantanitlerin 6. periyot 3B grubunda bulunduğunu anlayabiliriz. Hepsi bir kutuya sığmayacağı için, periyodik sistemin altına dizilmişlerdir.
Aktinitler
- Aktinitler, Aktinyum (Ac) elementi ile başlayan periyottaki elementlerin ortak adıdır.
- Aktinyum elementi ile başladıkları için de “Aktinit” adını alırlar.
- Aktinitler, toplam 14 tanedir.
- Proton sayılarının takip edersek, Aktinitlerin 7. periyot 3B grubunda bulunduğunu anlayabiliriz. Hepsi bir kutuya sığmayacağı için, periyodik sistemin altına dizilmişlerdir.
Grup ve Periyot Bulma
16S =
16S atomunun temel elektron dağılı şöyle olmalıdır:
16S16 : )2e– )8e– )6e–
Elekton dağılımına baktığımızda atomun son yörüngesinde 6 elektron görüyoruz. Bu yüzden bu atom 6A grubundadır. Elektron dağılımına bakarak atomun 3 tane yörüngesinin olduğunu görüyoruz. Bu yüzden bu atom 3. periyottadır.
| element | atom no | e- dizilişi | yeri |
| H | 1 | 1 | 1. periyot 1A grubu |
| Li | 3 | 2-1 | 2. periyot 1A grubu |
| C | 6 | 2-4 | 2. periyot 4A |
| O | 8 | 2-6 | 2. periyot 6A |
| Na | 11 | 2-8-1 | 3. periyot 1A grubu |
| K | 19 | 2-8-8-1 | 4. periyot 1A grubu |
| Br | 35 | 2-8-18-7 | 4. periyot 7A grubu |
METAL-AMETAL ve SOYGAZ’IN ÖZELLİKLERİ | ||
| Metal | Ametal | Soygaz |
|
5A(-3),6A,(-2)7A(-1)… Fakat(+) değerlik alabilirler.
|
|
PERİYODİK ÖZELLİKLERİN DEĞİŞİMİ
ATOM YARIÇAPI : Çekirdeğin merkezi ile en dış kabukta bulunan elektronlar arasındaki uzaklık olarak tanımlanır.
- Periyodik tabloda aynı periyotta soldan sağa doğru ilerledikçe atom yarıçapı küçülür.
- Çünkü bir atomdan diğerine geçerken çekirdek yükü artar. En son yörüngedeki elektronları çekim
kuvveti artacağından atom yarıçapı da küçülür.
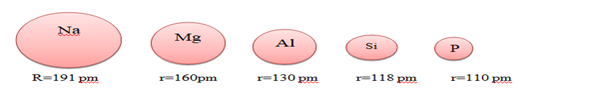

En dış yörüngedeki elektronlar çekirdekten daha da uzaklaşacağından çekirdek tarafından çekilme kuvveti azalır. Dolayısıyla da atom yarıçapı artar.
İYON YARIÇAPI: Nötr bir atom elektron vererek pozitif yüklü bir iyon oluşturabilir. İyon elektron verdikçe elektron başına düşen çekirdek çekim kuvveti artar ve çapı küçülür.
12Mg:2 -8- 2 12Mg+2:2 -8 Katmanı az olan taneciğin çapı daha küçüktür
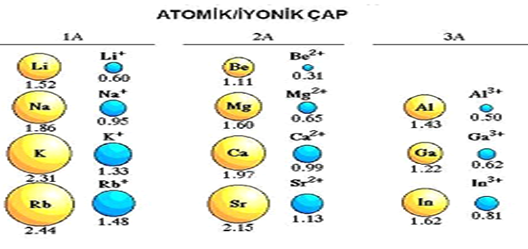
- Bir atom elektron aldıkça elektron başına düşen çekim kuvveti azalır ve anyonların
yarıçapı nötr atomlarınkinden büyük olur.
16S:2-8-6 16S-2:2-8-8
- Elektron sayısı arttığından elektron başına düşen çekim kuvveti azalır.
İZOELEKTRONİK TANECİKLERDE YARIÇAPLARININ KIYASLANMASI
- İzoelektronik taneciklerin elektron sayıları eşittir.
- Bu taneciklerde proton sayısına bakılır.
- PROTON SAYISI büyük olan yarıçapı küçüktür.
İYONLAŞMA ENERJİSİ:
Gaz halindeki nötr bir atomdan bir elektron koparmak için verilmesi gereken enerjiye denir.
- Bir atomun elektron sayısı kadar iyonlaşma enerjisi değeri ölçülebilir.
- Atomdan elektron uzaklaştırıldıkça atom yarıçapı azalır
- Elektron başına düşen çekim kuvveti artar.
- Her elektronu koparmak için gereken enerji bir öncekinden daha büyük olur.
Uyarı : Nötr atomun katı veya sıvı olmaması gerekir İyonlaşma enerjisi endotermik bir olaydır.
AYNI PERİYOTTA;
- Soldan sağa doğru yörünge sayısı değişmez.
- Ancak proton sayısı arttığı için yarıçap küçülür.
- Elektron koparmak için verilen enerji artar.
Aynı periyotta soldan sağa doğru ilerledikçe birinci iyonlaşma enerjileri
1A< 3A <2A < 4A < 6A< 5A< 7A< 8A
AYNI GRUPTA YUKARIDAN AŞAĞIYA DOĞRU İNİLDİKÇE:
- Atom yarıçapı artar.
- En dış yörüngedeki elektronları koparmak kolaylaşır.
- Atomların birinci iyonlaşma enerjisi azalır.
ELEKTRON İLGİSİ:
- Gaz halindeki bir atomun bir elektron alması sırasında açığa çıkan enerji değişimidir.
- Elektron ilgisi pozitif ve negatif olabilir.
- Elektron ilgisinin değeri eksi olması azaldığını göstermez. Negatiflik atomun elektron alma durumunda dışarıya verdiği enerjinin göstergesidir.
- Elektron almaya en yatkın olan halojenlerdir ve elektron ilgisi en yüksektir.
- Aynı periyotta soldan sağa doğru gidildikçe elektron ilgisi artar.
- Aynı grupta yukarıdan aşağıya doğru inildikçe elektron ilgisi genellikle azalır.(İstisna Klorun elektron ilgisi Florun elektron ilgisinden fazladır.)
- Soygazların elektron ilgisi çok küçük olmasından dolayı yok kabul edilir.
- Elektron ilgisi bir elementin elektron alma eğiliminin ölçüsüdür.
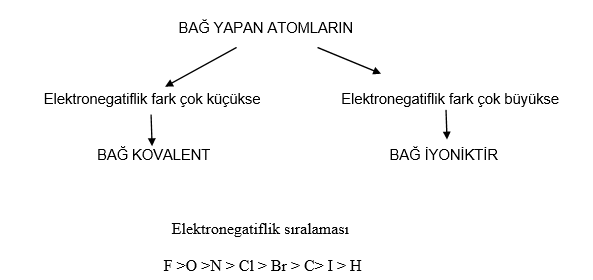
ELEKTRONEGATİFLİK:
- Bağ elektronlarını çekme yeteneğinin ölçüsüdür.
- Elektronegatiflik iyonlaşma enerjisi ve elektron ilgisi değerleri kullanarak ölçülebilir.
- Elektronegatifliği en yüksek element FLORDUR.
- Elektronegatiflik değeri 4 tür.

- Metallerin elektronegatiflikleri 1,7 değerinin altında, ametallerin ise 2,0 değerinin yukarısındadır.
- Bu iki değer arasında yer alan elementler yarı metaldir.
PERİYODİK CETVELDE;
- Aynı periyotta soldan sağa doğru gidildikçe genellikle elektronegatiflik artar
- Aynı grupta aşağıdan yukarıya doğru gidildikçe elektronegatiflik artar.
METALİK VE AMETALİK ÖZELLİK:
- En aktif metal 1A grubu Alkali metallerdir
- En aktif ametal ise 7A grubu Halojendir.
- Metallerin elektron verme eğilimleri yüksektir.
- Ametallerin ise elektron alma eğilimleri yüksektir.
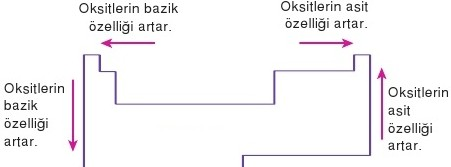
GENEL OLARAK ÖZETLERSEK
Periyodik tabloda soldan sağa doğru ilerledikçe
- Proton ve nöron sayısı ile birlikte kütle numarası da artar.
- Elektron sayısı artar ve atom numarası yükselir.
- Ametallik özelliği yani elektron alma isteği artar.
- Soldan sağa gittikçe yörünge sayısı değişmez.
- Elementin çapı ve atom hacmi azalır.
Periyodik tabloda yukarıdan aşağıya ilerledikçe
- Soldan sağa olduğu gibi proton ve nöron sayısı ile birlikte kütle numara artar.
- Elektron sayısı değişmez ancak atom numarası artar.
- Metallik özelliği yani elektron verme isteği artar.
- Yukarıdan aşağıya indikçe yörünge sayısı artar.
- Elementin çapı ve hacmi artar.11yldzferdi







Hiç yorum yok
Sizleri daha ilerilere taşıyabilmek için burdurdayız