Isı ve Sıcaklık
ISI VE SICAKLIK
Sıcaklık: Bir maddenin taneciklerinin ortalama kinetik enerjisinin göstergesidir.
Sembolü T ile gösterilir.
Birimi SI birim sisteminde Kelvin(K)dir.
Sıcaklık bir enerji türü değildir.
Temel Büyüklüktür
Termometre ile ölçülür.
Isı: Sıcaklığı farklı iki maddenin sıcaklığı yüksek olandan sıcaklığı az olana transfer ettiği enerjiye denir.
Sembolü Q ile gösterilir.
Birimi SI birim sisteminde joule(j)dür.
Isı bir enerji türüdür.
Türetilmiş Büyüklüktür.
Kalorimetre Kabı ile ölçülür.
İç Enerji: Maddenin moleküllerinin titreşiminden dolayı sahip olduğukinetik enerji ile moleküllerin bağlarından dolayı sahip olduğu potansiyel enerjinin toplamına denir.
- Madde cinsine
- Madde miktarına
- Madde sıcaklığına
bağlıdır.
Termometreler
Yüksek sıcaklıklar, metal termometreler ile ölçülür.
Hassas sıcaklıklar, gazlı termometreler ile ölçülür.
Günlük sıcaklıklar, sıvılı termometreler ile ölçülür.
Sıvılı termometrelerin hassas ölçüm yapabilmesi için,
- Hazne büyük olmalı
- Kılcal boru ince ve uzun olmalı
- Kılcal boru bölmelendirmesi fazla olmalı
- Genleşme katsayısı büyük bir sıvı tercih edilmeli
- Kullanılan katı malzemenin genleşme katsayısı kullanılmalı
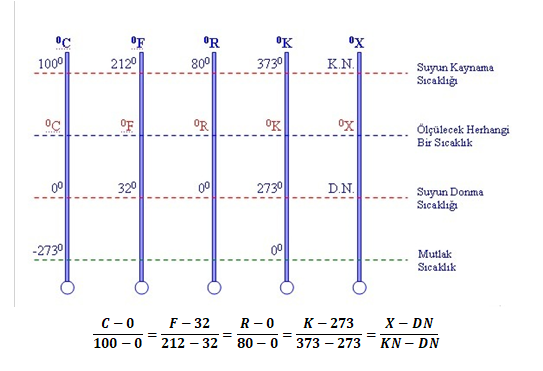
Sıcaklık Ölçekleri
Suyun kaynama ve donma noktasına göre farklı ölçekler içeren termometreler oluşturulmuştur.
Özısı: Bir maddenin bir gramının sıcaklığını 1°C değiştirmek için gerekli ısı miktarıdır.
- Özısı maddeler için ayırt edici bir özelliktir.
- ‘c’ ile sembolize edilir.
- Özısısı büyük maddeler geç ısınıp geç soğur.
Isı sığası: Bir maddenin sıcaklığı 1°C değiştirmek için gerekli ısı miktarıdır.
- ‘C’ ile sembolize edilir.
- C =m.c ile hesaplanır. ( m:kütle , c:özısı )
- Sıcaklık değişiminin matematiksel ifadesi
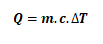
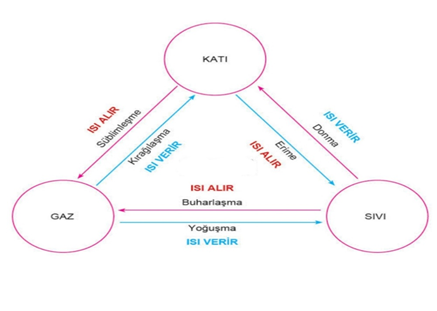
HAL DEĞİŞİMİ
Hal değişim ısısı: Bir maddenin bir gramının hal değiştirmesi için gerekli ısı miktarıdır.
- Ayırt edici özelliktir.
- ‘L’ ile gösterilir.
- Birimi cal/g dır.
- Bir maddenin erime ve donma ısıları eşittir.
- Bir maddenin yoğuşma ve kaynama ısıları eşittir.
Hal değişimi durumunda madde heterojen (katı+sıvı ya da sıvı+gaz)halde bulunur.
Hal değişimi matematiksel ifadesi:
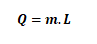
Hal değişim sıcaklığı: Bir maddenin hal değişimine başladığı sıcaklığa denir.
- Ayırt edici özelliktir.
- Bir maddenin (sabit saflıkta)
Erime noktası= Donma noktası
Kaynama noktası = Yoğuşmanoktası
Örneğin; su 0°C de donar, buz 0°C de erir.
NOTLAR
Erirken hacmi azalan maddelerde dış basınç artması erimeyi kolaylaştırır.
Erirken hacmi artan maddelerde dış basınç artması erime noktasını yükseltir, erimeyi zorlaştırır.
Dış basıncın artması kaynama noktasını yükseltir.(Düdüklü tencerenin çalışma prensibi buna dayanır)
Suya tuz eklemek kaynama noktasını yükseltir.
Yabancı madde eklenmesi (antifriz gibi) erime ve donma noktasını düşürür.

Isıl Denge
Dış ortamdan ısıca yalıtılmış cisimler arasında sıcaklık farkından dolayı ısı alışverişi gerçekleşir.
Isı akış yönü; sıcaklığı fazla olandan sıcaklığı az olana doğrudur.
Isı alışverişi ısıl sağlandığındamaddelerin sıcaklığı eşitlenir.
Bu sıcaklık;
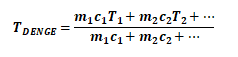
İle hesaplanır.
İki maddenin transfer ettiği ısı birbirine eşittir.
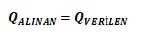
Son sıcaklık ısı sığası büyük olan maddenin ilk sıcaklığına yakın olur.
Hal değişim grafiği
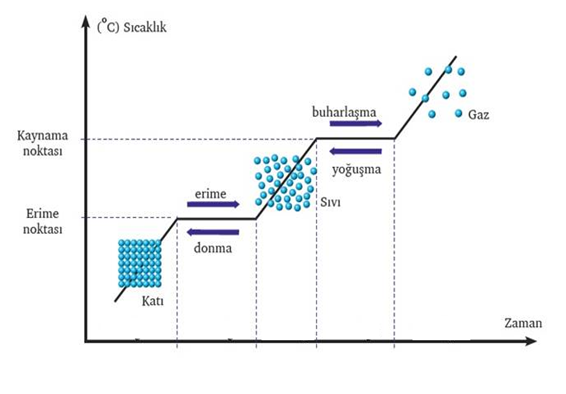
Sıcaklığın sabit olduğu noktalarda madde ısı alarak hal değiştirir. Bu noktalarda madde geçiş formundadır( Katı + Sıvı ya da Sıvı + Gaz ) .
ÖRNEK:
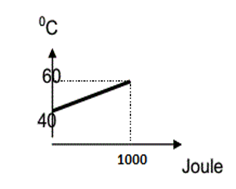
200 gram kütleli cismin ısı-sıcaklık grafiği verilmiştir. Buna göre cismin özısısı kaçtır?
ÇÖZÜM:
1000 =200.c.(60-40)
1000=200.c.20
1000=4000.c
c=0,5 cal/g°C
ISI İLETİM YOLLARI
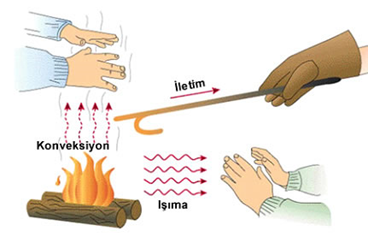
- Işıma
Isının tanecikler olmadan ışınlar sayesinde yayılmasına ışıma yoluyla ısı iletimi denir.Işımayla ısının yayılması boşlukta ve saydam ortamlarda gerçekleşir.
- Konveksiyon
Isının hava veya sıvı akımı ile yani taneciklerin yer değiştirmesi ile yayılmasına ısının konveksiyon yolu ile yayılması denir.Sıvı ve gazlarda görülenısının iletilme yoludur.
- İletim
Isının katılarda iletim şeklidir.Maddenin taneciklerinin birbirine çarparak ısı enerjisinin aktarılmasına iletim yoluyla ısının yayılması denir.









Hiç yorum yok
Sizleri daha ilerilere taşıyabilmek için burdurdayız